Антигенспецифичная терапия
Исследования, проходящие в настоящее время
INIT-2 является проектом Центра по разработке вакцин от диабета (The Diabetes Vaccine Development Centre — DVDC). DVDC — совместная инициатива правительства Австралии (Национальный Австралийский Совет по исследованиям в области здравоохранения — National Health and Medical Research Council) и Международного фонда исследований юношеского диабета (Juvenile Diabetes Research Foundation International). Миссия DVDC состоит в “ускорении разработки одной или более вакцин, которые должны будут предотвратить или замедлить прогрессирование начала диабета…”
Проект Diabetes Prediction and Prevention Study (DIPP) был запущен в 1994 г. в Финляндии. В этом исследовании новорожденные подвергаются скринингу на повышенный риск развития СД 1-го типа. Дети с высоким риском поступают под наблюдение: в течение первых 2 лет с 3-месячным интервалом и после 2 лет с 6-ме- сячным интервалом. Каждый раз у них исследуют образцы крови на антитела. У детей, позитивных по антителам к островковым клеткам, проводят глюкозотолерантный тест. Эти дети могут участвовать в исследовании по применению интраназального инсулина с целью предотвращения развития СД. В настоящее время в исследование включено более 8500 детей с высоким риском развития СД, более чем у 110 из них клинически манифестировал диабет.
Иммунотерапевтический препарат | Название и статус исследования | Количество участников и критерии включения в исследование | Путь введения и дозировка препарата | Результат | Источник |
DaiPep277 | Завершено | 50 взрослых в возрасте 16— 44 лет и 49 детей в возрасте в возрасте 4—15 лет с впервые выявленным СД 1-го типа | Взрослые: 4 подкожные инъекции 0,2, 1,0 или 2,5 мг. Дети: подкожно 4 инъекции р277 0,2 мг или 1,0 мг | Недостоверное улучшение при дозе 0,2 и 1,0 мг; достоверное отсутствие эффекта при дозе 2,5 мг | |
Человеческий рекомбинантный GAD65 (DIAMYD) | Завершено в 2005 г. | 47 пациентов с LADA диабе- DIAMYD 4, 20, 100 том в возрасте 30—70 лет и или 500 мкг подкож- антителами к GAD но на 1-й и 4-й не деле Исследования, проходящие в настоящее время | Положительный эффект в течение 24 мес при дозе 20 мкг: достоверное увеличение остаточной секреции С- пептида и снижение уровня НЬА|С, недостоверное увеличение стимулированной секреции С-пептида | ||
Человеческий рекомбинантный GAD65 (DIAMYD) | Начато в 2004 г. и является продолжением предыдущего исследования | 160 пациентов с LADA диабетом в возрасте 30—70 лет с антителами к GAD | Подкожно DI AMYD 20 мкг | NCT00456027* | |
Человеческий рекомбинантный GAD65 (GAD-Alum) | Планируется | Пациенты с длительностью СД 1 -го типа не более 3 мес в возрасте 8—45 лет. Уровень стимулированного С- пептида более 0,2 пмоль/мл с наличием антител к GAD | 1-я группа: 3 инъекции 20 мкг GAD-A1- um подкожно; 2-я группа: 3 инъекции подкожно, 2 из них 20 мкг с паузой в 4 нед, 3-я инъекция — гидроксид алюминия через 4 нед после 2-й | NCT00529399* | |
ДНК-вакцина, основанная на проинсулине (ВНТ-3021) | Продолжается | Планируется включить в исследование 72 больных СД 1-го типа в возрасте 18—40 лет с длительностью заболевания менее 5 лет, сохранной остаточной секрецией С-пептида и наличием минимум одного антитела из GAD, IA-2, IAA | Еженедельно, в течение 12 нед | NCT00453375* | |
Человеческий рекомбинантный GAD65 (DIAMID) | Продолжается | Дети и подростки в возрасте 10—18 лет с СД 1-го типа, диагностированным в течение 18 мес до включения в исследование, с уровнем С- пептида натощак более 0,1 нмоль/л и антителами к GAD | Подкожно DI AMYD 20 мкг | NCT00435981* | |
DiaPep277 | 2002 г. — настоящее время | 100 больных LADA диабетом [ в возрасте 30—65 лет с длительностью СД 1-го типа от 2 мес до 5 лет, положительных по GAD и с уровнем секреции С-пептида 0,30 нмоль/л и выше | На 0, 1 и 3-м месяце и затем каждые 3 мес, всего 8 инъекций. Длительность лечения 1,5 года, затем 6 мес наблюдения | NCT00058981* | |
DiaPep277 | 2005—2010 гг., 3-я фаза | 400 больных СД 1-го типа в возрасте 16—45 лет в течение 3 мес после манифестации СД с уровнем С-пептида 0,22 нмоль/л и выше и наличием минимум одного антитела | 1,0 мг подкожно, на 0,1,3,6,9,12,15,18 и 21-м месяце | NCT00615264* | |
DiaPep277 | 2008-2112 гг. | Планируется включить в исследование 50 пациентов из предыдущего исследования (NCT00615264), прошедших полный курс лечения DiaPep277 и с сохраненной секрецией С-пептида (0,22 нмоль/л и выше) | 1,0 мг подкожно на 0, 3, 6, 9, 12, 15, 18, 21-м месяце | NCT00644501* | |
Вакцина на основе участков HLA | ■ | http:// |
Примечание. * — Идентификатор клинических исследований (http://www.ClinicalTrials.gov).
Диабет у детей: симптомы, профилактика
Заместитель главного врача по детству государственного учреждения здравоохранения «Городская клиническая больница № 2 г. Тулы им. Е. Г. Лазарева» Татьяна Николаевна Корягина ответила на вопросы и рассказала, почему возникает сахарный диабет, и нужно ли детям проходить обследование у эндокринолога.
Число людей, больных сахарным диабетом, неуклонно растет. Каковы причины возникновения заболевания?
Сахарный диабет – заболевание, характеризующееся постоянным избыточным уровнем глюкозы в крови. Это заболевание одно из серьезных, приводящее к инвалидности ребенка.
У детей, как правило, встречается первый тип диабета. Для него характерен чрезмерно высокий уровень глюкозы в крови. Поэтому ребенок нуждается в постоянном введении инсулина.
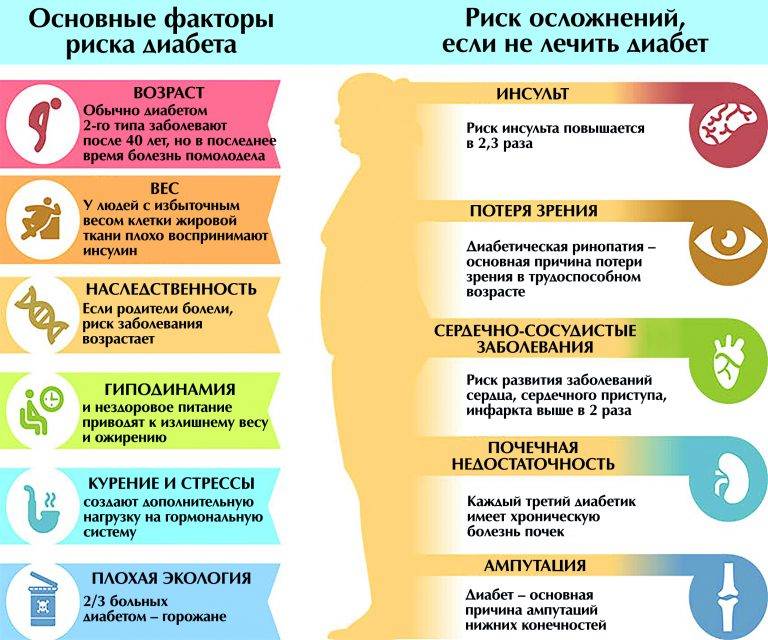
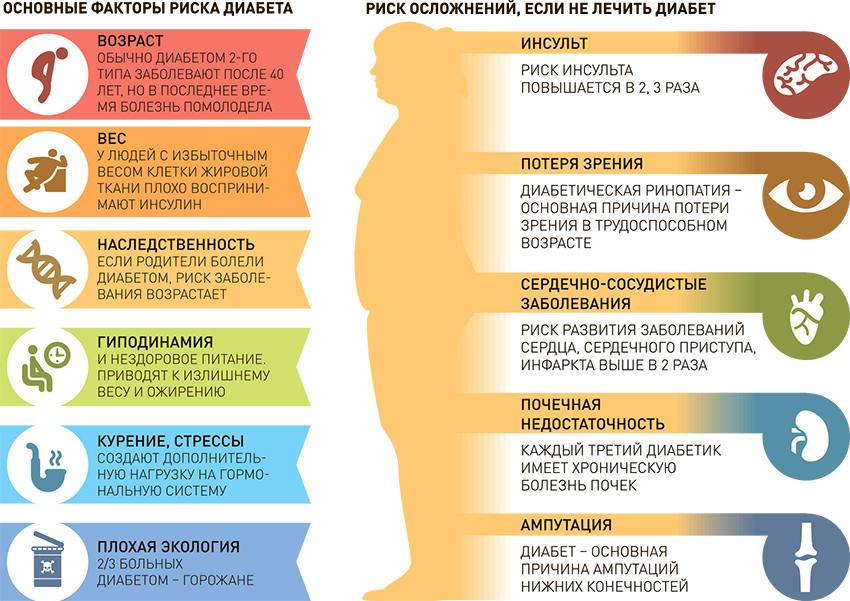
Основные причины, отягощающие развитие сахарного диабета у ребенка:
– оба родителя или только мать больны сахарным диабетом;
– избыточный вес в момент рождения (более 4,5 кг);
– вирусные болезни;
– ожирение;
– нарушенный обмен веществ;
– слабый иммунитет.
На что нужно обращать внимание родителям?
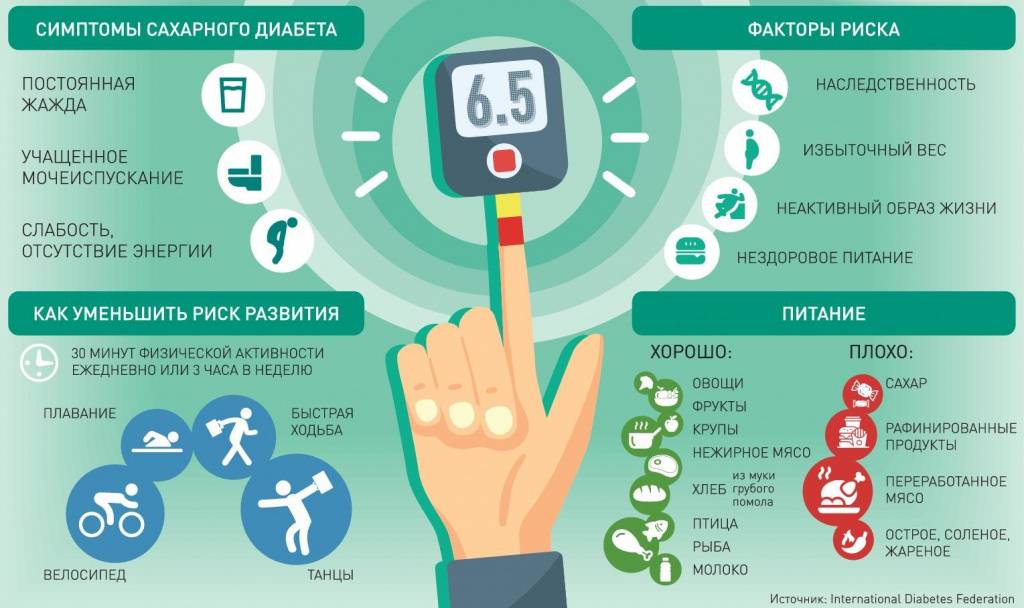
На ранних стадиях симптомы сахарного диабета у ребенка могут не проявляться. Насторожить должны следующие признаки:
– снижение веса при повышенном аппетите;
– жажда;
– избыток мочи (более 2 литров в сутки);
– осложнения при инфекциях, их тяжелая форма протекания;
– плохая концентрация внимания;
– быстрая и сильная утомляемость;
– зуд в промежности после мочеиспускания;
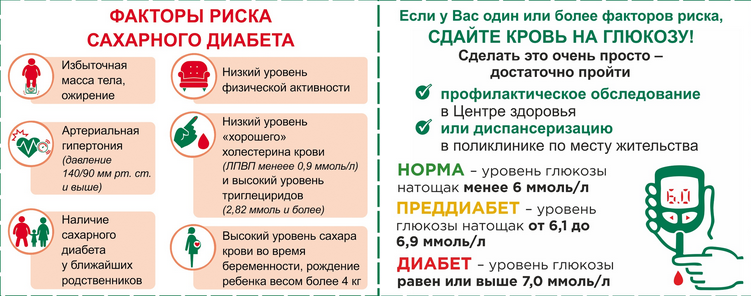
– повышение глюкозы в крови более 5,6 ммоль/л;
– тошнота и рвота;
– снижение зрения (стремительное).
При обнаружении этих признаков необходимо срочно обратиться к врачу-педиатру для проведения обследования и консультирования с врачом-эндокринологом.
Что нужно знать и делать родителям при обнаружении сахарного диабета у ребенка?
– Иметь представление о характере заболевания и его возможных последствиях.
– Строго следить за соблюдением ребенком рекомендаций врача по лечению заболевания путем своевременного ввода инсулина специальной шприц-ручкой, удобной в применении, так как ребенок может сам заправлять ее, устанавливать дозу введения и вводить препарат.
– Обеспечить постоянный контроль за соблюдением ребенком режима питания, количества и состава пищевых продуктов.
– Изменить характер питания ребенка, придерживаясь следующих принципов:
отказаться от мучного и макаронных изделий; сократить количество потребления жиров животного происхождения; отдавать предпочтение фруктам (с небольшим содержанием сахаров), овощам и зелени; исключить из рациона питания ребенка копчености, острые пряные закуски и приправы, возбуждающие аппетит; вторые блюда лучше готовить на пару (противопоказаны гуси, утки, жирная баранина, свинина) и без соли, слегка подсаливая их в готовом виде (в день разрешается не более 4-5 г соли).
– Осуществлять ежедневный контроль уровня глюкозы в крови у ребенка при помощи глюкометра.
– Планировать заранее действия при нарушении обычного режима (дальняя поездка, визит в гости или в театр, физическая нагрузка), не забывая, что ребенку, находящемуся на инсулине, необходимо постоянно носить с собой сладкую конфету или 1-2 яблока для предотвращения гипогликемии.
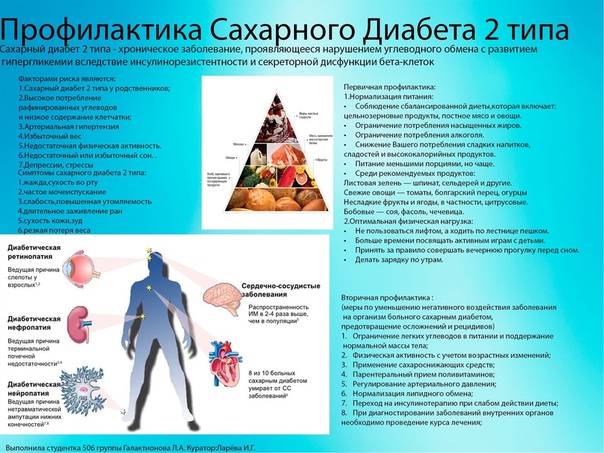
Профилактика сахарного диабета у детей
Профилактика сахарного диабета у детей главным образом определяется правильным питанием, если он – не наследственный. Ограничьте своих детей в приеме сладенького и хлебобулочных фабрикатов; необходимо значительно снизить употребление сладкой газированной воды и шоколадок; отменить «чупа-чупсы» и сухарики. Рацион должен быть насыщен овощами, фруктами, кисломолочными продуктами.
Нужно устранять факторы риска этой болезни: предупреждать вирусные заболевания, обучить ребенка правильно воспринимать стрессовые ситуации, контролировать массу тела и заниматься спортом.
Антигеннеспецифичная терапия
Исследования, проходящие в настоящее время
В настоящее время продолжаются исследования по использованию с профилактической целью витамина D3, гидролизата коровьего молока и докозагексаеновой кислоты (см. табл. 4). Использование витамина D3 основано на эпидемиологических исследованиях, показавших, что добавление его грудным детям связано с существенным снижением риска развития СД. На моделях NOD- мышей было продемонстрировано повышение риска развития диабета при исключении витамина D3 из рациона питания и в то же время предотвращение СД использованием 1,25-дигидроксивитамина D3. В экспериментах in vitro было установлено, что эффект витамина D3 может быть связан с его воздействием на антигенпре- зентацию и активацию Т-клеток.
Докозагексаеновая кислота относится к полиненасы- щенным жирным кислотам омега-3, которые являются незаменимыми элементами питания, так как не образуются в организме человека. Омега-3 жирные кислоты конкурируют с омега-6 жирными кислотами. Оба типа полиненасыщенных жирных кислот являются предшественниками серии биологически активных веществ: простагландинов, простациклинов, тромбоксанов и лейкотриенов, которые участвуют в воспалительных реакциях и влияют на многие физиологические функции организма. При этом простагландины, образующиеся из омега-6 и омега-3 полиненасыщенных жирных кислот, являются антагонистами. Простагландины и лейкотриены омега-3 оказывают противоаллергическое, противовоспалительное, противоболевое действие в противоположность продуктам метаболизма арахидоновой кислоты — омега- 6. За последнее столетие потребление омега-3 значительно снизилось и в то же время увеличилась заболеваемость СД, особенно среди детей. Было отмечено, что дети, получающие дополнительно омега-3 жирные кислоты, имеют меньший риск развития диабета. На основании этого было высказано предположение о протективном действии омега-3 жирных кислот во время беременности и в неонатальном периоде. Механизм действия может быть связан с противовоспалительным эффектом омега-3 жирных кислот.
Идея исследования TRIGR (Trial to Reduce IDDM in the Genetically at Risk) основывается на данных, полученных еще в 80-х годах, о меньшем риске диабета среди детей, находившихся на грудном вскармливании. Белки коровьего молока часто являются первыми антигенами, получаемыми с пищей, с которыми сталкивается иммунная система ребенка. Возможно, что она еще недостаточно зрелая и не может адекватно воспринимать пищевые белки, что приводит к цепной реакции с развитием аутоиммунного поражения р-клеток поджелудочной железы. На животных было показано снижение риска развития диабета при переходе на гидролизованное коровье молоко в отличие от необработанного коровьего молока.
Причины распространенности сахарного диабета.
- Поздняя диагностика заболевания. Как правило, в 50% случаев сахарный диабет 2 типа выявляется на 5-7 году от начала заболевания, и как следствие 20-30% имеют специфические сосудистые осложнения на микро и макро уровне. Не редки случаи поражения коронарных артерий, болезни периферических сосудов. И это не полный список возможных осложнений, которые выявляются на момент установки диагноза.
- Отсутствие настороженности у пациентов и врачей при наличии факторов риска.
- Недостаточный контроль заболевания. Повышение уровня гликированного гемоглобина (HbA1c тест) на 1% сопровождается ростом риска смерти, связанной с диабетом на 21%, микрососудистых осложнений на 37%, поражения периферических артерий на 43%.
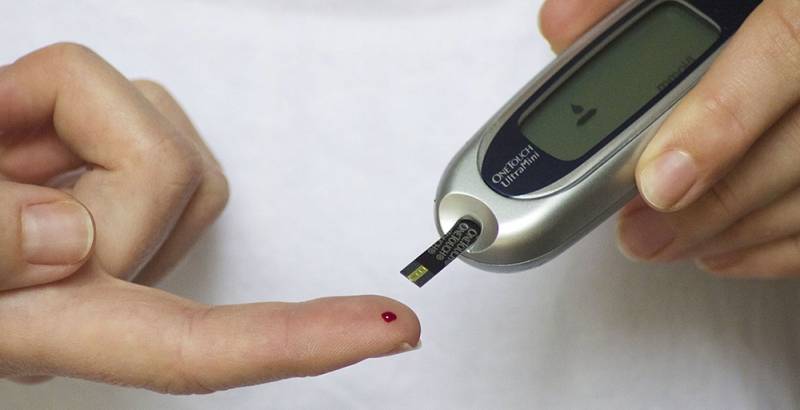
По данным Государственного Регистра больных СД установлено, что практически 75% больных имеют уровень HbA1c > 7,0%. Более того, среди тех, кто постоянно наблюдается у врача, только у 43% пациентов уровень гликированного гемоглобина меньше 8,0%. Это означает, что больше половины наших больных находятся в зоне высокого риска.
Список литературы
1. Agardh C. D., Cilio C. M., Lethagen A. et al. // J. Diabet. Compl. – 2005. – Vol. 9. – P. 238-246.
2. Akerblom H. K., Virtanen S. M., Ilonen J. et al. // Diabetologia. – 2005. – Vol. 48. – P. 829-837.
3. Allen H. F., Klingensmith G. J., Jensen P. et al. // Diabetes Care. – 1999. – Vol. 22. – P. 1703-1707.
4. Alleva D. G., Maki R. A., Putnam A. L. et al. // Scand. J. Immunol. – 2006. – Vol. 63. – P. 59-69.
5. Atkinson M. A., Leiter E. H. // Nat. Med. – 1999. – Vol. 5. – P. 601-604.
6. Atkinson M. A. // ADA Outstanding Scientific Achievement Lecture. – 2004. – Vol. 54. – P. 1253-1263.
7. Bohmer K. P., Kolb H., Kuglin B. et al. // Diabetes Care. – 1994. – Vol. 17. – P. 138-141.
8. Buscema M., Vinci C., Gatta C. et al. // Metabolism. – 1992. – Vol. 41. – P. 296-300.
9. Carel J. C., Boitard C., Eisenbarth G. et al. // J. Autoimmun. – 1996. – Vol. 9. – P. 739-745.
10. Carrascomarin E., Shimizu J., Kanagawa O., Unanue E. R. // J. Immunol. – 1996. – Vol. 156. – P. 450-458.
11. Chatenoud L., Primo J., Bach J. F. // J. Immunol. – 1997. – Vol. 58, N 6. – P. 2947-2954.
12. Chatenoud L. // Curr. Dir. Autoimmun. – Basel, 2001. – Vol. 4. – P. 333-350.
13. Corper A. L., Stratmann T., Apostolopoulos V. et al. // Science. – 2000. – Vol. 288. – P. 505-511.
14. Dahlquist G., Gothefors L. // Diabetologia. – 1995. – Vol. 38. – P. 873-874.
15. DPT-1 Diabetes Study Group // N. Engl. J. Med. – 2002. – Vol. 346. – P. 17685-1691.
16. Elias D., Cohen I. R. // Lancet. – 1994. – Vol. 343. – P. 704-706.
17. Elliott R. B., Pilcher C. C., Stewart A. et al. // Ann. N. Y. Acad. Sci. – 1993. – Vol. 696. – P. 333-341.
18. Fuchtenbusch M., Rabl W., Grassl B. et al. // Diabetologia. – 1998. – Vol. 41. – P. 536-541.
19. Gale E. A., Bingley P. J., Emmett C. L., Collier T. // Lancet. – 2004. – Vol. 363. – P. 925-931.
20. Harrison L. C., Honeyman M. C., Steele C. E. et al. // Diabetes Care. – 2004. – Vol. 27. – P. 2348-2355.
21. Heller B., Wang Z.-Q., Wagner E. F. et al. // J. Biol. Chem. – 1997. – Vol. 270. – P. 11176-11180.
22. Hummel M., Bnifacio E., Naserke H. E., Ziegler A. G. // Diabetes Care. – 2002. – Vol. 25. – P. 1111-1116.
23. Huppmann M., Baumgarten A., Ziegler A. G., Bonifacio E. // Diabetes Care. – 2005. – Vol. 28. – P. 204-206.
24. Huurman V. A., Decochez K., Mathieu C. et al. // Diabet. Metab. Res. Rev. – 2007. – Vol. 23, N 4. – P. 269-275.
25. Keller R. J., Eisenbarth G. S., Jackson R. A. // Lancet. – 1993. – Vol. 341. – P. 927-928.
26. Kolb H., Burkart V., Appels B. et al. // J. Autoimmun. – 1990. – Vol. 3. – P. 117-120.
27. Kuhn R., Lohler J., Rennick D. et al. // Cell. – 1993. – Vol. 75. – P. 263-274.
28. Lampeter E. F., Klinghammer A., Scherbaum W. A. et al. // Diabetes. – 1998. – Vol. 47. – P. 980-984.
29. Lazar L., Ofan R., Weintrob N. et al. // Diabet. Metab. Res. Rev. – 2006. – Publ. online: 24 November 2006 DOI: 10.1002/dmrr.711
30. Lazarow A., Liambies J., Tausch A. J. // J. Lab. Clin. Med. – 1997. – Vol. 38. – P. 249-258.
31. Lund T. et al. // Nature. – 1990. – Vol. 345. – P. 727-729.
32. Maki T., Ichikawa T., Blanco R., Porter J. // Proc. Natl. Acad. Sci. USA. – 1992. – Vol. 89. – P. 3434-3438.
33. Miyazaki T. et al. // Nature. – 1990. – Vol. 345. – P. 722-724.
34. Parent M. E., Siemiatycki J., Menzies R. et al. // Diabetes Care. – 1997. – Vol. 20. – P. 767-772.
35. Raz I., Elias D., Avron A. et al. // Lancet. – 2001. – Vol. 358. – P. 1749-1753.
36. Raz I., Elias D., Avron A., Tamir M. // Ann. N. Y. Acad. Sci. – 2006. – Vol. 1079. – P. 340-344.
37. Reich E. P., Sherwin R. S., Kanagawa O., Janeway C. A. J. // Nature. – 1989. – Vol. 341. – P. 326-328.
38. Sadelain M. W., Qin H. Y., Lauzon J., Singh B. // Diabetes. – 1990. – Vol. 39. – P. 583-589.
39. Schloot N. C., Meierhoff G., Lengyel C. et al. // Diabet. Metab. Res. Rev. – 2007. – Vol. 23, N 4. – P. 276-285.
40. Schmidt D., Verdaguer J., Averill N., Santamaria P. // J. Exp. Med. – 1997. – Vol. 186. – P. 1059-1075.
41. Shull M. M., Ormsby I., Kier A. B. et al. // Nature. – 1992. – Vol. 359. – P. 693-699.
42. Singer S. M., Tisch R., Yang X. D., McDevitt H. O. // Proc. Natl. Acad. Sci. USA. – 1993. – Vol. 90. – P. 9566-9570.
43. Singer S. M. et al. // Diabetes. – 1998. – Vol. 47. – P. 1570-1577.
44. Skyler J. S., Krischer J. P., Wolfsdorf J. et al. // Diabetes Care. – 2005. – Vol. 28. – P. 1068-1076
45. Slattery R. M. et al. // Nature. – 1990. – Vol. 345. – P. 724-726.
46. Staeva-Vieira T., Peakman M., von Herrath M. // Clin. Exp. Immunol. – 2007. – Vol. 148. – P. 17-31.
47. Tang Q. et al. // Nat. Immunol. – 2006. – Vol. 7. – P. 83-92.
48. Todd J. A., Acha-Orbea H., Bell J. I. et al. // Science. – 1988. – Vol. 240. – P. 1003-1009.
49. Uehira M. et al. // Int. Immunol. – 1989. – Vol. 1. – P. 209-213.
50. Yamada K., Nonaka K., Hanafusa T. et al. // Diabetes. – 1982. – Vol. 31. – P. 749-753.
51. Yonemura Y., Takashima T., Miwa K. et al. // Diabtes. – 1984. – Vol. 33. – P. 401-404.
52. Zanin-Zhorov A. et al. // FASEB J. – 2003. – Vol. 17. – P. 1567-1569.